
活性化エネルギーって何?
どんな意味を持っているの?
そんな悩みを解決します。
・活性化エネルギーとは【衝突理論で解説】
・【応用】衝突理論でアレニウスの式を導く
この記事を読めば、衝突理論により活性化エネルギーの正体を理解することができます。

私は化学製品のプロセス設計をしてきました。
その経験をもとに分かりやすく解説します。
☑ 化学メーカー生産技術職
☑ 工学修士(専攻:化学工学)
活性化エネルギーとは【衝突理論で解説】
活性化エネルギーEaは、反応を起こすような衝突に必要な最低限の運動エネルギーを表しています。
活性化エネルギーが大きいほど反応速度の温度依存性が大きい(アレニウスプロットの傾きが急な)ことを示します。
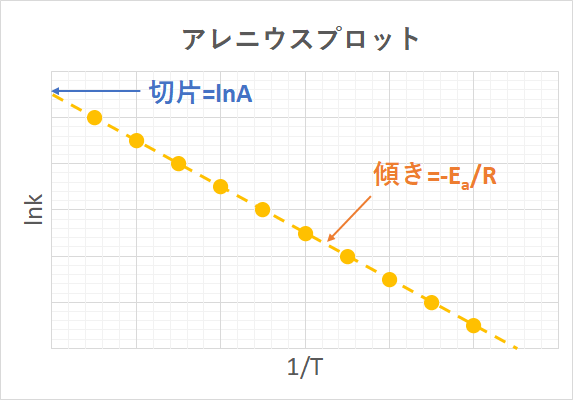
「活性化エネルギーEa」と「頻度因子A」はアレニウスパラメーターと呼び、反応速度の温度依存性を表すアレニウスの式の重要な要素です。
$$lnk=lnA−\frac{E_a}{RT}$$
次のようにも書きます。
$$k=Ae^{−E_a/RT}$$
k:反応速度定数[l/(mol・s)]
A:頻度因子[l/(mol・s)]
Ea:活性化エネルギー[J/mol]
R:気体定数[J/(K・mol)]
T:温度[K]
アレニウスの式、活性化エネルギーと頻度因子の求め方については以下の記事で詳しく解説しています。
 アレニウスの式、アレニウスプロットとは【活性化エネルギー、頻度因子の求め方】
アレニウスの式、アレニウスプロットとは【活性化エネルギー、頻度因子の求め方】

活性化エネルギーの正体は気体分子の衝突理論を用いると理解しやすいため、解説します。
衝突理論ではこのように考えます。
2つの分子が接近する線上で活性化障壁を超える運動エネルギーを
持っている→化学反応が起こる
持っていないとき→化学反応が起こらない

活性化障壁とは、2つの分子が接近したときの分子のポテンシャルエネルギーの最大値のことです。
2つの分子が接近すると、化学反応を起こそうと分子の結合が曲がり、歪み壊れポテンシャルネルギーが最大値に達します。
そして新たな結合ができポテンシャルエネルギーが減少し始めます。
この分子のポテンシャルエネルギーの最大値(活性化障壁の高さ)が反応の活性化エネルギーの正体です。
【応用】衝突理論でアレニウスの式を導く
衝突理論からアレニウスの式を導くことができます。
衝突理論によれば、反応速度は以下のように表すことができます。
反応速度は衝突頻度と衝突の成功率に比例する。
反応速度∝衝突頻度×反応の成功率
比例定数を用いれば、反応速度を以下のように表せる。
反応速度=比例定数×衝突頻度×反応の成功率
「衝突頻度」と「反応の成功率」のついて解説します。
衝突頻度
衝突頻度は化学種AとBの濃度に比例します。
$$衝突頻度∝[A][B]$$
例えばAの濃度が2倍になれば衝突頻度も2倍、AとB両方の濃度がそれぞれ2倍になれば衝突頻度は4倍になるということです。
反応の成功率
反応の成功率は、衝突する分子が衝突する方向に沿って少なくとも活性化障壁を超えるだけの運動エネルギーを持っている割合を示します。
$$反応の成功率=e{−E_a/RT}$$
反応の成功率は統計熱力学のボルツマン分布を応用して求めることができます。
アレニウスの式を衝突理論で導く
衝突理論の式に「衝突頻度」と「反応の成功率」の式を代入すると以下のようになります。
反応速度=比例定数×衝突頻度×反応の成功率
$$反応速度=A×[A][B]×e^{−E_a/RT}$$
これを2次反応の速度式と比較すると
$$反応速度=k[A][B]$$
つまり、アレニウスの式そのままであることがわかります。
$$k=Ae^{−E_a/RT}$$
この比例定数Aが頻度因子です。
頻度因子は反応物の濃度と反応の成功率を結ぶ定数であることがわかります。
まとめ
活性化エネルギーの正体を衝突理論を用いて解説しました。
活性化エネルギーは化学反応の速度を決める重要な因子です。
本質を理解して使いこなせるようにしておきましょう。
反応速度について体系的に学ぶには物理化学の参考書がおすすめです。
 初学者におすすめの物理化学の参考書7選
初学者におすすめの物理化学の参考書7選  化学プラント大全
化学プラント大全 